“化敌为友,去腐生新” -医用臭氧通过激活AMPK/Gas6/MerTK/SOCS3信号轴促进巨噬细胞胞葬功能缓解神经病理性疼痛
“化敌为友,去腐生新” -医用臭氧通过激活AMPK/Gas6/MerTK/SOCS3信号轴促进巨噬细胞胞葬功能缓解神经病理性疼痛
神经病理性疼痛(Neuropathic Pain, NPP)是由直接或者间接的神经损伤诱发的慢性疼痛,随着中国进入老年化社会,其发病率逐年升高。有文章报道其发病率为7%-10%,特征为感觉异常和痛觉过敏。目前该疾病的治疗方案多以离子通道阻断和炎症因子抑制为主要策略,因为神经细胞的再生能力有限,目前的绝大部分药物并不是以促进神经修复为主要目的,因此现有的方案对于NPP的治疗效果有限。因此积极探索神经病理性疼痛的发病机制并寻找新的治疗策略,尤其寻找能够促进神经修复的“标本兼治”的治疗方法具有重要的临床价值与社会意义。
过去二十年的基础研究证实凋亡细胞的聚集和神经炎症在NPP的病理机制中起着至关重要的作用。疾病进程中凋亡细胞( apoptosis cells,ACs )的清除需要吞噬细胞表达识别与凋亡细胞相关配体的受体,促进吞噬体的形成以降解凋亡细胞,这一过程被称为胞葬作用(Efferocytosis)。胞葬作用不仅可以清除凋亡细胞,还可以通过降低炎症因子的表达甚至释放抗炎因子IL-10和组织修复因子TGF-β发挥主动退炎和组织修复作用。而当胞葬作用受损时,以上提及的内源性保护功能被破坏,导致炎症加重和疾病迁延不愈。因此,增加巨噬细胞胞葬功能,减少病灶处凋亡细胞的累积从而缓解神经病理性疼痛可能是一个全新的治疗思路。
近日,南京医科大学刘文涛教授课题组在《Frontiers in immunology》杂志上发表了一篇名为“Ozone promotes macrophage efferocytosis and alleviates neuropathic pain by activating the AMPK/Gas6-MerTK/SOCS3 signaling pathway”的工作。该研究首次证明了医用臭氧可通过激活AMPK/Gas6/MerTK/SOCS3信号通路,促进巨噬细胞加速清除凋亡细胞,显著增强胞葬功能减轻神经炎症反应,最终显著缓解神经病理性疼痛。这个研究为治疗神经病理性疼痛提出了新的策略,并为医用臭氧治疗更多的临床转化提供了强有力的基础研究证据。
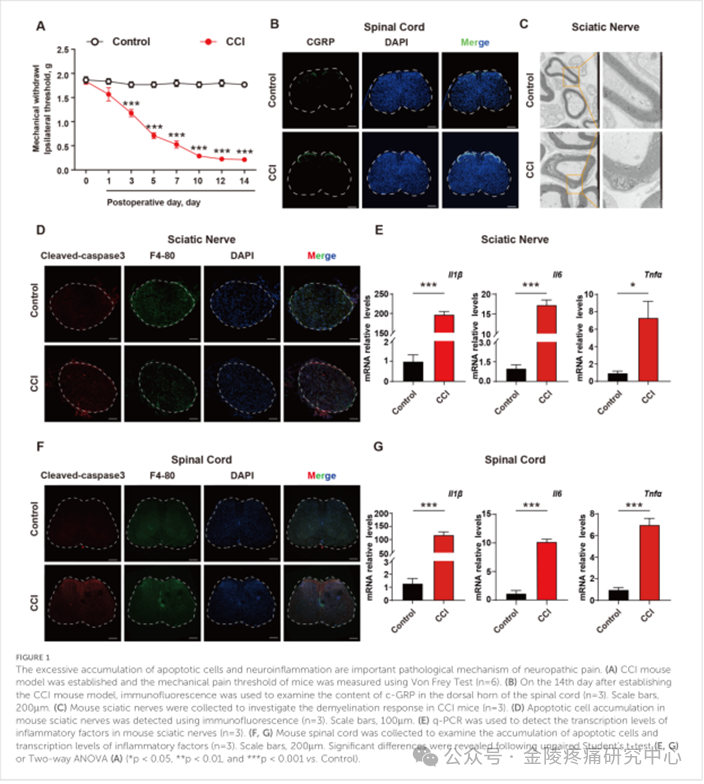
为了评估医用臭氧对NPP的治疗效果,研究人员首先建立了慢性坐骨神经结扎损伤模型(Chronic constriction injury model,CCI),这是一种在实验室中用于模拟人类神经病理性疼痛的动物模型,使用Von Frey测试来评估小鼠的机械疼痛阈值,结果显示CCI小鼠与对照组相比表现出机械超敏反应(图1A)。从小鼠中收集脊髓,发现CCI小鼠脊髓背角中的cGRP含量增加(图1B)。透射电子显微镜用于观察小鼠的坐骨神经,揭示CCI小鼠的坐骨神经中的显著脱髓鞘反应(图1C)。为了进一步探索其机制,使用切割的半胱天冬酶3(作为凋亡细胞的标记物)以及炎症因子水平来研究坐骨神经和脊髓中凋亡细胞的积累因素。结果表明,CCI可诱导凋亡细胞明显增多,周围巨噬细胞明显浸润,炎症因子IL-1b、TNF-α、INF-γ的转录水平升高(图1D-G,补充图S1)。结果表明,在CCI小鼠中,存在凋亡细胞和神经炎症的过度累积,这是NPP发生发展的重要病理机制。
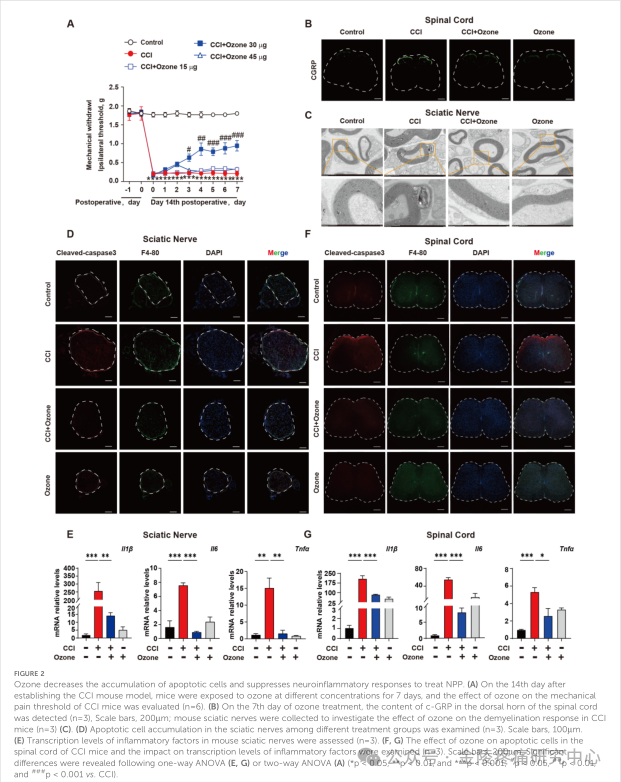
医用臭氧疗法已被广泛用于治疗各种疾病,包括COVID-19,皮肤病和疼痛管理。课题组以前的研究表明臭氧在化疗引起的肠炎和神经性疼痛有前途的治疗效果。为了进一步研究臭氧在NPP中的作用机制,课题组首先通过小鼠连续腹腔注射浓度为15 mg,30 mg和45 mg的臭氧,结果显示,浓度为30 mg的臭氧显著减轻了CCI小鼠的机械超敏反应(图2A)。进一步的研究表明,臭氧可以减少凋亡细胞的积累,抑制神经炎症反应,治疗NPP。
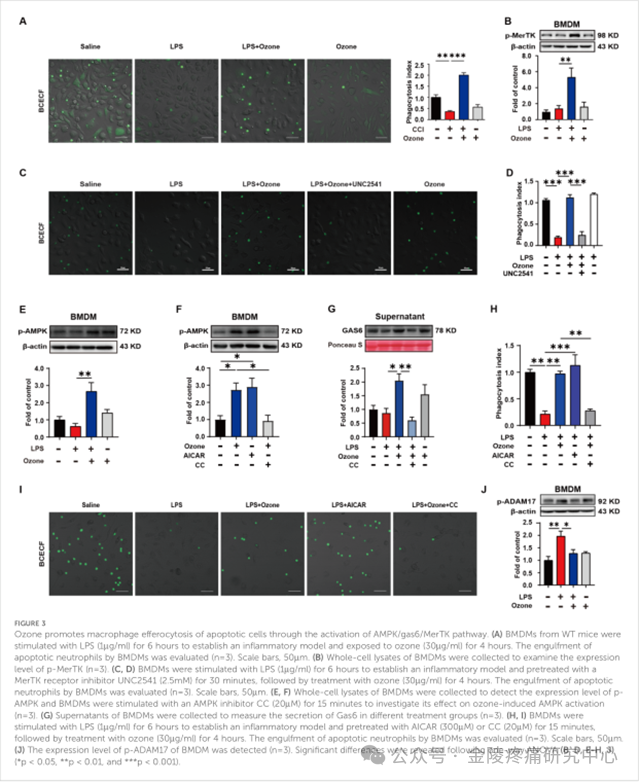
为了进一步探讨臭氧抑制凋亡细胞积累的机制,课题组从WT小鼠中提取BMDM,用LPS(1 mg/ml)刺激6小时以建立炎症模型,模拟体内神经炎症反应。凋亡中性粒细胞用于模拟凋亡细胞的过度积聚。评估了BMDM对凋亡中性粒细胞的吞噬清除能力,结果显示LPS刺激的BMDM对凋亡中性粒细胞的吞噬功能显著障碍,而臭氧可以促进BMDM对凋亡细胞的吞噬作用(图3A)。此外,与LPS刺激相比,臭氧处理的BMDM中磷酸化Mer受体酪氨酸激酶(pMerTK)的表达显著增加,表明臭氧可以激活巨噬细胞受体MerTK(图3B)。进一步用MerTK抑制剂UNC2541预处理BMDM,显著抑制了BMDM对凋亡中性粒细胞的吞噬(图3C,D)。课题组进一步发现LPS刺激抑制AMPK活化,而臭氧处理显著上调p-AMPK的表达(图3E)。用AMPK激活剂AICAR刺激BMDM也上调了p-AMPK,并且当使用AMPK抑制剂CC时,这种作用被逆转,消除了臭氧诱导的AMPK激活(图3F)。此外,据报道,生长停滞特异性6(Gas6),MerTK受体的重要桥接分子,与AMPK活化相关。细胞培养物上清液中Gas6水平的测量揭示臭氧上调Gas6的表达,其也被CC处理抵消(图3G)。AMPK激活与MerTK介导的巨噬细胞吞噬功能之间的关系。结果表明,LPS刺激导致BMDM细胞功能受损,而臭氧处理逆转了这种情况。AICAR通过促进BMDM对凋亡中性粒细胞的吞噬和清除来模拟臭氧的作用。然而,AMPK抑制剂CC取消了臭氧对凋亡细胞的吞噬作用(图3 H,I)。另一方面,由蛋白酶如含有解整合素和金属蛋白酶结构域的蛋白17(ADAM17)对MerTK受体的蛋白水解脱落可导致炎性巨噬细胞中的吞噬功能障碍和可溶性Mer片段的产生。这些可溶性片段与桥接分子GAS6结合,阻止GAS6与完整MerTK受体之间的相互作用。ADAM17是负责切割MerTK的主要蛋白酶,这可能是LPS刺激BMDM时p-MerTK表达降低的原因。课题组检查了磷酸化的ADAM 17(p-ADAM17)的表达水平,发现臭氧显著降低了p-ADAM17的水平(图3 J),这表明臭氧也可以通过抑制ADAM17介导的MerTK切割来上调MerTK。这些研究结果表明,臭氧通过激活AMPK/Gas6通路和抑制ADAM17激活,促进巨噬细胞上MerTK介导的吞噬作用,治疗神经性疼痛。
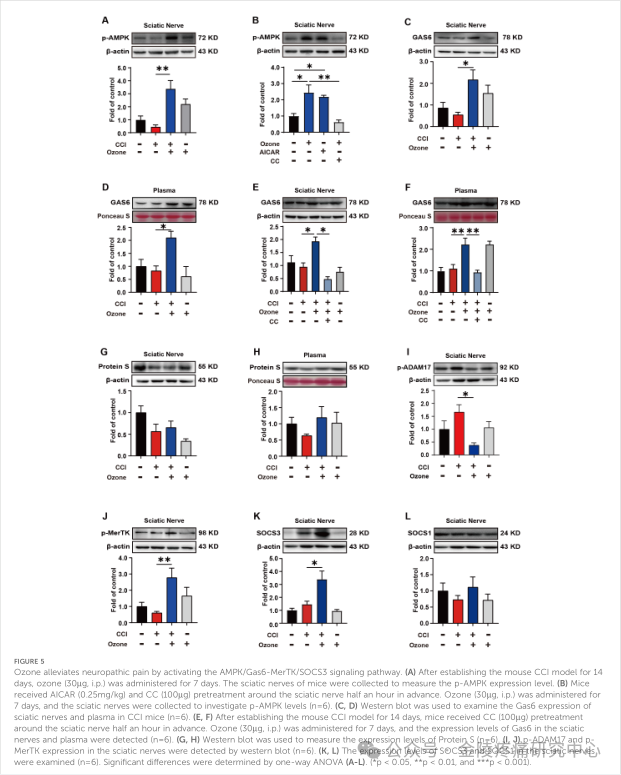
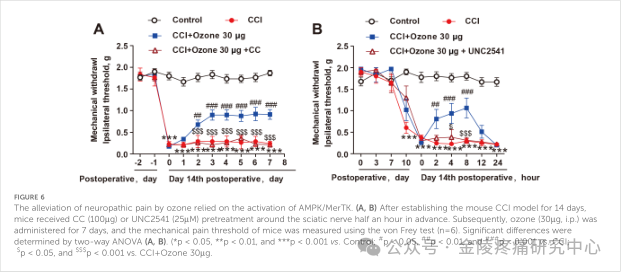
为了验证臭氧对神经病理性疼痛过程中炎症反应的影响,课题组检测了两种内源性的胞内炎症抑制因子SOCS3和SOCS1的表达水平。实验结果表明,臭氧促进SOCS3的表达,而不是SOCS1的表达(图4A、B)。为了研究SOCS3在炎症中的作用,课题组检测了BMDM中炎性细胞因子的转录水平,结果表明,臭氧主要通过上调SOCS3来促进抗炎作用。在体实验中,课题组最终验证了臭氧通过激活AMPK/Gas6-MerTK/SOCS3信号通路,促进巨噬细胞对凋亡细胞吞噬并抑制神经炎症以减轻神经病理性疼痛。
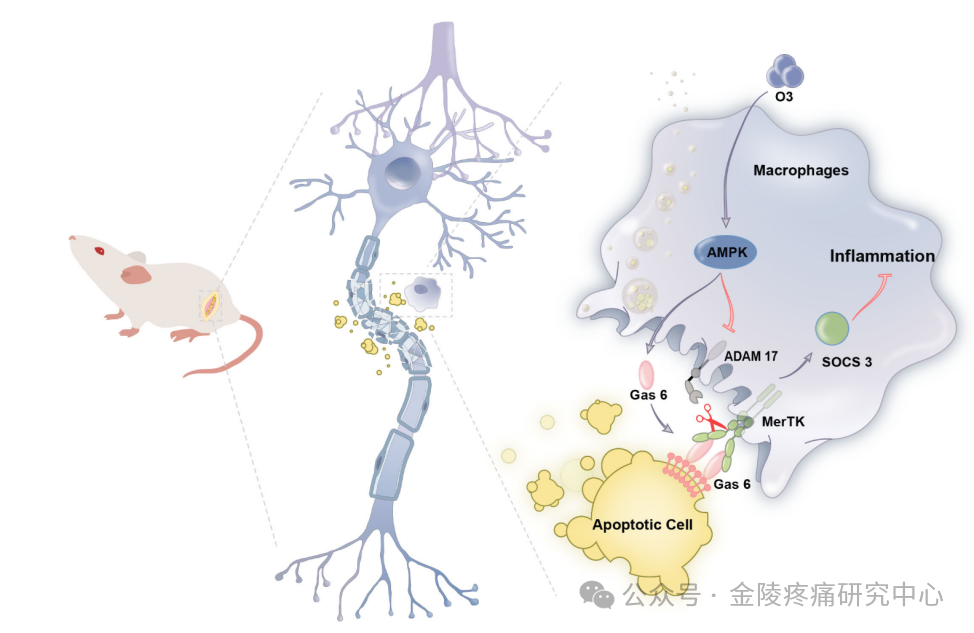
总的来说,南京医科大学的这项研究为我们提供了一个全新的视角:这个研究中,巨噬细胞不再是以敌人的角色参与了神经痛的诱发,该研究利用医用臭氧这个在中国疼痛科广泛应用的疗法,通过AMPK-GAS6-MerTk这个轴,利用释放出来的GAS6主动“驯养”了巨噬细胞,“化敌为友”将巨噬细胞的吞噬功能和衰老细胞的主动清除、消化再利用有机的结合起来。
本研究提供了一种新的促进而不是抑制固有免疫,通过“去腐生新”的策略从根本上治疗神经病理性疼痛的新视角。结合该课题组在2017,2020,2023年,2024年发表的另外四篇有关医用臭氧抗神经病理性疼痛,抗化疗性肠炎,抗痛风痛,抗脓毒性肺损伤的基础与转化结合的文章,该系列研究不仅仅揭示了医用臭氧镇痛抗炎促修复的深层次机理,更为神经病理性疼痛的治疗提供了新的策略,还为医用臭氧治疗的更多临床转化提供了理论支持【详见参考文献】。
该研究的通讯作者为南京医科大学生殖与子代健康国家重点实验室的胡凡博士,南京医科大学第一附属医院的潘寅兵主任和南京医科大学基础医学院药理学系的刘文涛教授。南京医科大学基础医学院硕士生阮诗蓉,博士研究生贾茹梦,基础医学院胡亮副教授和伊犁哈萨克自治州友谊医院刘玉革主任为本文的共同第一作者。
该研究得到了国家自然科学基金和山东省泰山产业领军人才计划的资助。
参考文献:
【1】Ruan S, Jia R, Hu L, Liu Y, Tian Q, Jiang K, Xia X, Tao X, Liu W-T, Pan Y, Hu F. Ozone promotes macrophage efferocytosis and alleviates neuropathic pain by activating the AMPK/Gas6-MerTK/SOCS3 signaling pathway. Front Immunol. 15:1455771. doi: 10.3389/fimmu.2024.1455771
【2】Fan W, Liu C, Chen D, Xu C, Qi X, Zhang A, Zhu X, Liu Y, Wang L, Hao L, Liu WT, Hu L. O Ozone alleviates MSU-induced acute gout pain via upregulating AMPK/GAS6/MerTK/SOCS3 signaling pathway. J Transl Med. 2023 Dec 8;21(1):890. doi: 10.1186/s12967-023-04769-1.
【3】 Yan C, Zhang Y, Jin L, Liu X, Zhu X, Li Q, Wang Y, Hu L, He X, Bao H, Zhu X, Wang Q, Liu WT. Medical ozone alleviates acute lung injury by enhancing phagocytosis targeting NETsvia AMPK/SR-A1 axis. J Biomed Res. 2024 May 25;38(6):1-16. doi: 10.7555/JBR.38.20240038.
【4】Yu Q, Yang X, Zhang C, Zhang X, Wang C, Chen L, Liu X, Gu Y, He X, Hu L, Liu WT, Li Y. AMPK activation by ozone therapy inhibits tissue factor-triggered intestinal ischemia and ameliorates chemotherapeutic enteritis. FASEB J. 2020 Sep;34(9):13005-13021. doi: 10.1096/fj.201902717RR.
【5】Lu L, Pan C, Chen L, Hu L, Wang C, Han Y, Yang Y, Cheng Z, Liu WT. AMPK activation by peri-sciatic nerve administration of ozone attenuates CCI-induced neuropathic pain in rats. J Mol Cell Biol. 2017 Apr 1;9(2):132-143. doi: 10.1093/jmcb/mjw043.
版权声明:本文章版权归金陵疼痛研究中心所有,未经授权不得转载!
![]()

温馨提示:点击下方图片查看详情。













